困擾男性數千年的「殺手」 何時迎來大結局?
在葡萄牙首都里斯本的國家考古博物館裡,存放著一具古埃及中年男性的木乃伊。前不久,科學家對這具屍體研究後發現,其骨盆和腰椎之間有許多高密度的圓形腫瘤,這是前列腺癌的典型表現。而且,他的前列腺癌已經擴散,遍及全身多處骨骼。
從古埃及到現在,2000多年過去了。如今,前列腺癌已經是男性最常見的癌症之一,每9名男性中,就有1人會在一生中罹患前列腺癌。不過據美國癌症協會的權威報告統計,與1993年相比,前列腺癌患者在2014年的死亡率銳減51%。這反映了前列腺癌診療在過去幾十年里的巨大進步。在今天的這篇文章中,葯明康德內容團隊也將與各位讀者一道,重溫人類的前列腺癌對抗史。
 從首例前列腺癌到兩個諾獎
從首例前列腺癌到兩個諾獎
現在的人們很難想像,前列腺癌在1853年被首次確診時,竟被認為是「一種非常罕見的疾病」。在接下來的近一個世紀里,科學家和醫生們取得的進展也極為有限。上世紀40年代,前列腺癌是死亡的代名詞,確診後,患者的生存期僅有1-2年。
轉機出現在1941年。這一年,美國芝加哥大學的查爾斯·哈金斯(Charles Huggins)教授與合作夥伴們發表了多篇論文,揭示了激素與前列腺之間的關係。理論上講,前列腺的生長與發育依賴於雄激素的作用。因此前列腺癌可能也和雄激素有所關聯。換而言之,如果能抑制雄激素的功能,或許就能抑制前列腺癌的生長。
 查爾斯·哈金斯教授
查爾斯·哈金斯教授
而在哈金斯教授的這一系列研究中,科學家們確認了雄激素與雌激素會展開競爭,相互抑制。與他們先前所設想的一樣,通過給患者注射雌激素,能夠有效地延緩前列腺癌的病情進展。此外,他們還發現通過手術切除睾丸,也能取得類似的效果。因此,這種通過降低雄激素水平來治療腫瘤的做法,也被稱作是「去勢治療」。
不少科學家認為,這是人類首次通過使用某種化學物質來成功控制前列腺癌的病情。由於發現了這種激素療法,哈金斯教授也斬獲了1966年的諾貝爾生理學或醫學獎。
哈金斯教授的重大發現揭開了前列腺癌內分泌療法的帷幕。在此後幾十年里,科學突破層出不窮,多種抑制雄激素的藥物也相繼出現。其中一個重要的推動來自於安德魯·薩利(Andrew Schally)教授團隊。他們的研究表明,一種叫黃體生成素釋放激素(LHRH)的下丘腦激素,可以通過一系列生化通路,最終促進睾酮的生成,而睾酮正是一種主要的雄激素。基於這個發現,科學家們開發出了一種叫做LHRH類似物的藥物。在患者體內,高水平的LHRH類似物能夠抑制睾酮的生成,同樣起到治療效果。由於發現LHRH,薩利教授也與另外兩名科學家一道,分享了1977年的諾貝爾生理學或醫學獎。
 安德魯·薩利教授
安德魯·薩利教授
激素療法不斷突破瓶頸
然而道高一尺,魔高一丈。隨著時間推移,人們逐漸發現在去勢治療後,癌細胞會逐漸適應這種低激素水平的環境,繼續生長。此時,疾病也進展成為了「去勢抵抗性前列腺癌」(CRPC)。因為前列腺癌病程較長,這幾乎是所有前列腺癌後期一個不可避免的階段,患者的中位生存期也只有1到2年。
去勢抵抗性前列腺癌的存在一度讓抑制雄激素的內分泌療法陷入瓶頸,治療僅依賴於化療和放療等極其有限的手段。直到新世紀,相關治療領域才終於又迎來了新的突破。
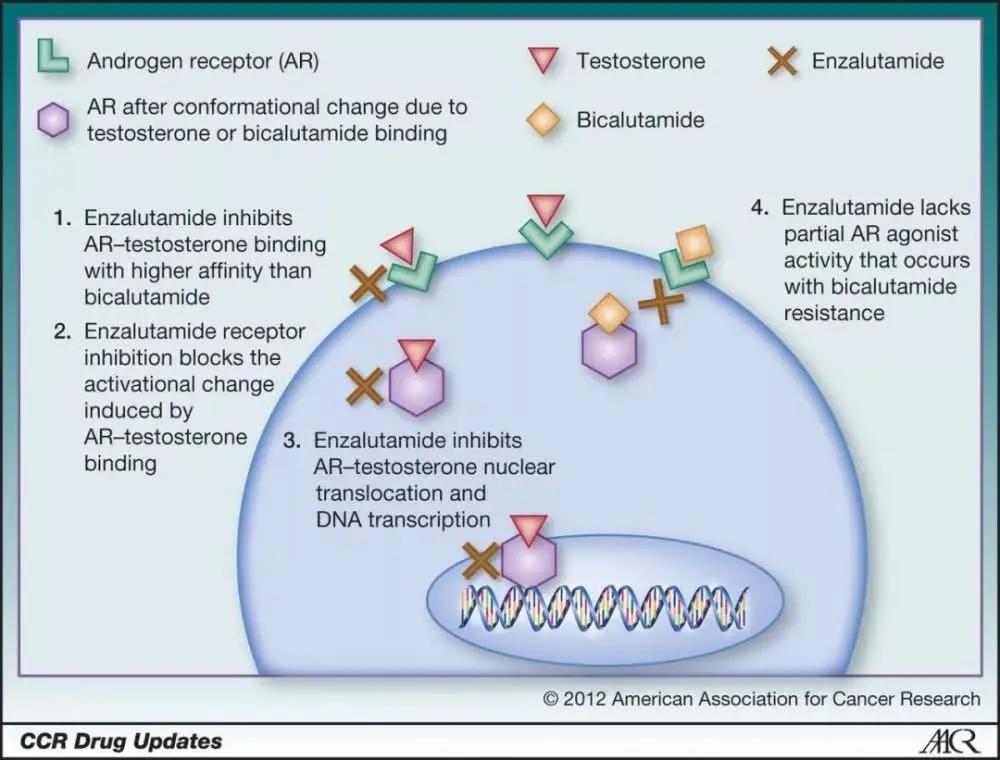
其中的突破之一是「抗雄激素療法」。與先前的療法不同,這類療法直接作用於雄激素受體,抑制雄激素與其結合,做得更為徹底。事實上,早在1989年,第一代抗雄激素療法flutamide就已獲美國FDA批准上市。然而早期抗雄激素與雄激素受體的親和力並不高,因此限制了這類療法的應用。
2012年,由Medivation(後被輝瑞收購)與安斯泰來(Astellas)共同開發的Xtandi(enzalutamide)獲批上市。作為新一代抗雄激素療法,它既能抑制雄激素與其受體結合,還能抑制雄激素受體進入細胞核,阻止它啟動下游的生化通路。在罹患去勢抵抗性前列腺癌,且病情已發生轉移,化療都無能為力的患者中,倘若接受了Xtandi的治療,有一半的患者能活過18.4個月。這一數字比安慰劑對照組多出了近5個月。
 Xtandi作用機理
Xtandi作用機理
值得一提的是,就在今年9月,Erleada還獲批治療去勢敏感性的前列腺癌,進一步擴大了能夠造福的人群。在臨床試驗中,它顯著延長了患者的總生存期,並將死亡風險減少了33%。而Xtandi在治療激素敏感性前列腺癌的臨床實驗中,同樣達到了延長總生存期的終點,有望在今年年底前獲批。
目前,中國也已有3家葯企的二代抗雄激素葯進入3期臨床試驗,包括恆瑞醫藥的SHR3680、開拓葯業的普克魯胺和海思科的HC-1119。
 抑制雄激素信號通路的藥物機制
抑制雄激素信號通路的藥物機制
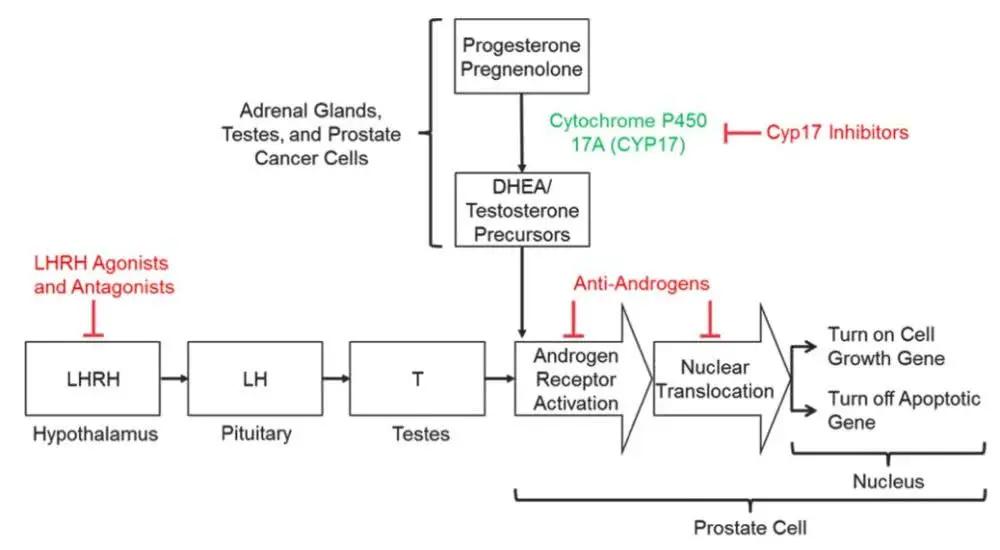
在二代抗雄激素之外,還有2011年獲FDA批准的Zytiga(abiraterone)這種新的激素療法。它雖然也能抑制雄激素,但原理並非提供相對抗的激素,也不是直接對抗其受體。相反,它靶向的是雄激素合成途徑中的一個關鍵酶CYP17。
作為一種高效、選擇性、不可逆的CYP17酶抑製劑,Zytiga能夠阻斷睾丸、腎上腺組織、前列腺癌組織中雄激素的合成,最大程度地降低體內雄激素水平。在一項有1195名患者參與的大型3期臨床試驗中,它的療效也得到了確認。
「武器庫」擴容:治療方法多元化
激素療法雖然不斷獲得突破,但是始終依靠抑制雄激素受體信號通路來遏制癌細胞的增殖。然而癌細胞最終會通過各種方式對激素療法產生抗性。因此,研究人員也在開發多種不基於雄激素信號通路的創新療法,為抗擊前列腺癌的武器庫中添加多元化的武器。
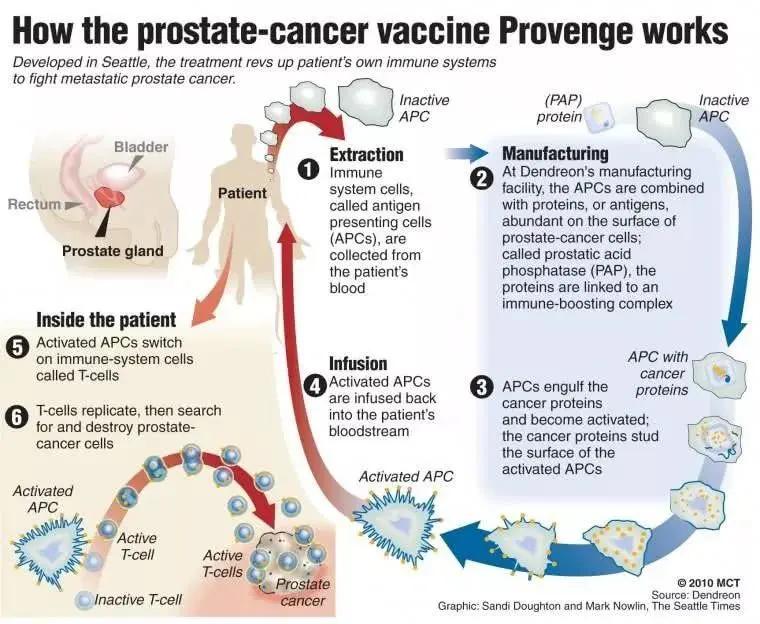
其中一種創新療法是全球首款「治療型」的腫瘤疫苗Provenge(sipuleucel-T)。作為一種個體化療法,它會從患者的血液中分離出樹突狀細胞(一種抗體呈遞細胞),並和一種特殊的融合蛋白共同培養。這種融合蛋白分為兩部分,一種是前列腺酸性磷酸酶(PAP),這也正是前列腺癌細胞上的主要抗原;另一種則是免疫信號因子,促進這些抗體呈遞細胞變得成熟。隨後,這些經過處理,能夠有效識別前列腺癌抗原的細胞又會被輸回患者體內,並激活免疫T細胞,讓其找到並殺傷表達PAP的癌細胞。3期臨床試驗結果也確認,它能夠顯著提高患者的中位生存期。
令人欣喜的是,最近一項研究結果發現,這些被腫瘤疫苗所激活的免疫細胞還具有長期記憶力,有望發揮長期的治療效果。
 腫瘤疫苗Provenge作用機理
腫瘤疫苗Provenge作用機理
除此之外,默沙東的明星免疫療法Keytruda(pembrolizumab)也在早期的臨床試驗中取得了積極的結果,並已增加三項3期臨床試驗。將來,它也有望為前列腺癌患者帶來福音。
除了上述的免疫療法,根據癌症的分子特徵而開發的靶向療法也已成為癌症治療的最新趨勢。在前列腺癌方面,最新的突破來自PARP抑製劑的應用。例如,今年八月,默沙東(MSD)和阿斯利康(AstraZeneca)宣布,Lynparza(olaparib)在治療轉移性去勢抵抗前列腺癌(mCRPC)男性患者的3期臨床試驗中取得積極結果,這些患者攜帶同源重組修復基因突變(HRRm)且既往接受激素抗癌治療(如enzalutamide和阿比特龍)後疾病進展。
未來的方向:預防與新療法將構建強有力的防線
在前列腺癌療法取得一系列突破的同時,前列腺癌的診斷也取得了重要的突破。目前,一種叫做前列腺特異抗原(PSA)的蛋白質已經過了幾十年的驗證,能用於前列腺癌的早期篩查、輔助診斷、治療監測、以及指導預後。最近,《柳葉刀》一項長達13年的隨訪結果顯示,在55-69歲男性中,PSA篩查使前列腺癌死亡率下降了21%,而且與隨訪9年和11年的結果相比,這種獲益呈增長趨勢。這也印證了早期篩查對前列腺癌的重要性。
當前,雖然前列腺癌的發病率依舊高居不下,但這在一定程度上也反映了診斷篩查技術的進步。在一系列可用的療法下,患者的疾病已能得到很好的控制與治療。確診前列腺癌,也不再等於會在短期內離開人世。
在這些進步面前,科學家們也沒有停下研發的步伐,無論在患者早篩還是創新療法開發方面都取得了積極進展。例如,近日Bio-Techne公司基於外泌體的液體活檢測試獲得美國FDA授予的突破性醫療器械認定。它可以讓前列腺癌患者無需接受侵襲性組織活檢,就可以判斷前列腺癌的類型。
在創新療法的開發方面,楊森公司近日宣布,PARP抑製劑尼拉帕利獲得FDA的突破性療法認定,治療去勢抵抗性前列腺癌患者。今年5月,葯明康德合作夥伴Arvinas宣布其領先的PROTAC蛋白降解療法ARV-110斬獲美國FDA授予的快速通道資格。ARV-110可以直接降解雄激素受體,它可以對雄激素受體過度表達或產生突變的癌症患者產生療效,從而造福那些對第二代激素療法缺乏響應的mCRPC患者。目前這款療法已經進入臨床試驗,初步數據有望在今年晚些時候公布。
隨著早期篩查技術和創新療法的不斷湧現,人類能否早日消滅前列腺癌這個困擾男性數千年的殺手?讓我們拭目以待吧!
來源:葯明康德

